DETERMINACION DE PH Y PREPARACIÓN DE SUERO FISIOLÓGICO - Informe de laboratorio #8 Bioquímica I
Informe de Laboratorio #8
POTENCIAL DE HIDROGENIONES
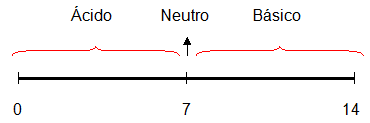
El pH o potencial de hidrogeniones es un parámetro que sirve para medir o expresar la acidez o la alcalinidad de un líquido. Se define como el exponente positivo de la concentración de los iones del Hidrógeno (hidrogeniones). El pH suele tomar valores entre 0 y 14, un pH de 7 es neutro y no es ni ácido ni básico. Un pH entre 0 y 7 indica que la sustancia es ácida. Un pH entre 7 y 14 le denomina básica. Cuanto mas alejado este el valor de 7, mas ácida o básica será la sustancia.
Soluciones Ácidas [H+] >1.10-7 M, pH<7
Soluciones Neutras [H+] = 1.10-7 M, ph=7
Soluciones Básico. [H+] < 1.10-7 M, pH>7
INDICADOR DE PH
Un indicador es sustancia natural o sintética que cambia de color en respuesta a la naturaleza de su medio químico. Los indicadores se utilizan para obtener información sobre el grado de acidez o pH de una sustancia, o sobre el estado de una reacción química en una disolución que se está valorando o analizando.
En la tabla se muestran algunos indicadores ácido-base, o de pH, con sus intervalos de viraje (intervalos de pH en los que cambian de color) y sus distintos colores según se encuentren en medio ácido o básico:
Sustancia
|
Intervalo de pH
|
En ácido
|
En base
|
Azul de bromofenol
|
3,0 - 4,6
|
Amarillo
|
Púrpura
|
Anaranjado de metilo
|
3.1-4.4
|
Rojo
|
Amarillo
|
Rojo de metilo
|
4.2-6.2
|
Rojo
|
Amarillo
|
Azul de bromotimol
|
6.0-7.6
|
Amarillo
|
Azul
|
Tornasol
|
5.8-8.0
|
Rojo
|
Azul
|
Fenolftaleína
|
8.0-9.8
|
Incoloro
|
Rojo – Violeta
|
Amarillo de alizarina
|
10.1-12.0
|
Rojo Fenol

El rojo fenol es un indicador de pH que cambia a color amarillo si hay acidez y a rojo si hay alcalinidad.
Orthotolidine Chlorine OTO
Detector de cloro, indicador de la potabilidad
DETERMINACIÓN DEL PH
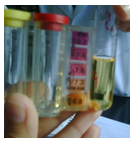
Agua de la llave
Con rojo fenol (1 gota)
RESULTADO Color amarillo pH 6.8
Con Orthotolidine Chlorine OTO (5 gotas)
RESULTADO 0.5 de cloro
Agua de pozo
Rojo fenol (1 gota)
RESULTADO Color rojo pH + 8.2
Agua transformada de mar
Rojo fenol (2 gotas)
RESULTADO Color rojo púrpura pH + 8.2
SUERO FISIOLÓGICO
El suero fisiológico es una disolución acuosa de sustancias compatibles con los organismos vivos debido a sus características definidas de osmoticidad, pH y fuerza iónica. Está compuesto de agua, electrolitos y, a veces, distintas sustancias, como por ejemplo la glucosa, fuente de carbono y energía para el organismo, y de algunos polisacáridos expansores. Se emplea como sustituto de la sangre cuando disminuye drásticamente la volemia y como vía de aplicación de diversas sustancias (por ejemplo, inyectables).
PREPARACIÓN DE SUERO FISIOLÓGICO
0.9 g% ClNa
45 ClNa -------- en ½ litro
- Se pesa 4,5 g de ClNa
- Se separa medio litro de agua en un recipiente
- Se coloca esta cantidad en el recipiente
- Se revuelve hasta que quede disuelto el ClNa
Prueba #1
50 ul de sangre

5 ml de suero
- Se coloca 5 ml de suero en un tubo
- Al tubo se le agrega 50 ul de sangre
- Se centrifuga el tubo a 3000 rpm por 1 min
RESULTADO
Se asentó la parte sólida, se guarda los eritrocitos que no se alteraron.
Prueba #2
50 ul de sangre
5 ml de agua
- Se coloca 5 ml de agua en otro tubo
- Al tubo se le agrega 50 ul de sangre
- Se centrifuga el tubo a 3000 rpm por 1 min
RESULTADO
No se asentó nada. Se hemolizó las células sanguíneas.
* Siguiente informe de laboratorio
* Anterior informe de laboratorio



Ojo, el suero fisiológico es NaCl al 0,9% eso es 0,9 grs en 100 ml de agua destilada, por lo que para preparar 500 ml son necesarios 4,5 grs y no 45!
ResponderEliminarMuchas gracias por tu aportación. El cambio a sido dado al documento.
ResponderEliminarSaludos.
He visto videos publicados por internet de preparacion del suero fisiologico y de manera casera en un vaso con agua de aprox 200 ml equivalentes a 200 g de la sustancia proponen 2 cucharaditas de cafe o un 1/4 de la cuchara. Si hacemos el calculo juiciosamente sabemos que los pesos moleculares de las sustancias no son iguales por consiguiente 0,9 g de NaCl en 100 ml implicaria que la densidad de las dos sustancias es igual y no es así. Otro análisis el peso molecular del NaCl es 58,44 g/mol y el del agua es de 18,02 g/mol si consideramos la ley de Dalton para producir 1000 ml de la disolución tendriamos que considerar las masas de los dos compuestos!!!!
ResponderEliminarSi quisieramos preparar 500 ml de la disolución como lo plantea el ejercicio al 0,9% de NaCl tendriamos que agregar a 485,7 ml de agua 6,623 g de NaCl. Considerando la ley de proporciones multiples de Dalton. Recuerden los pesos moleculares de las dos sustancias no son iguales y las densidades tampoco.
ResponderEliminarAlguien podria apoyarme con la informacion de ph de esta agua??
ResponderEliminar